医療機器メーカ様 プロセス規格:EN62304への対応
製品設計プロセスの改善 ~短期間での規格適合(医療機器ソフトウェアの機能安全)~
- ものづくり
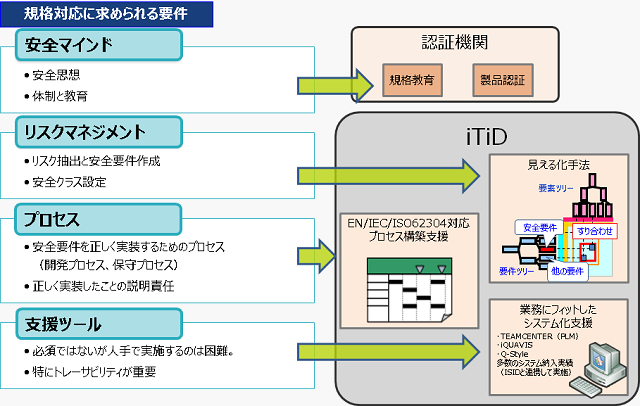
EU加盟国へ製品を輸出・販売する場合には関連する規格に適合していることを証明する必要があります。医療機器業界では、2008年11月にソフトウェアライフサイクルのプロセス規格であるEN62304が、欧州医療機器指令に対して規格整合化されました。これに伴い、A社のアプリケーションソフトにおいてもEN62304規格適合が求められるようになりました。
規格取得だけをゴールとせず、開発者が安全性に配慮する製品設計プロセスを実現する
A社では過去にISOやCMMIをベースに柔軟性が少なく使いにくいプロセスを実装してしまい、苦労した経験がありました。そこで、今回の規格対応を通して、よりよい製品開発につながり、開発者が自ら安全性に配慮しながら製品設計するようなプロセスの実現に向けて改善活動に取り組みました。
①プロセス規格と開発プロセスのギャップ分析
ITIDが作成したテンプレートを用いて、EN62304規格要求事項と現状の製品設計プロセスの相違を調査・分析しました。その結果、「リスクアセスメントプロセス」「保守関連のプロセス」および「ソフト開発時の要求変更に伴うシステム要件の変更を中心としたプロセス」が不足していることが分かりました。
②プロセス要件および改善方針の検討
製品設計プロセス要件を整理し、改善の方向付けを行いました。基本として、既存プロセスの活用によりこれまでの開発業務の流れは大きく変えずに規格を満足するプロセスを実現することにしました。特に、市場へリリースされた製品に対するフィードバックは、国や地域によって情報伝達の流れが異なっており、今回の規格対応を通じて、的確な情報収集を実現して変更を分析するプロセスを定義することにしました。また、製品検討時にアプリケーションソフトだけでなく、製品開発者や品質保証のリスク出しが弱かった為、リスク管理の進め方も定義する事にしました。
③プロセス定義
プロセス定義にあたってはITID所有のテンプレートを用いました。今回の定義活動は、アプリケーション開発部だけでなく、電気開発部のファームウェア開発担当者、品質保証部の担当者ら部門を超えた関係者を招集し、実務レベルでどこまで実施できているか、改善したプロセスはどのようにすれば受け入れられるかまで議論しながら実施しました。
9ヶ月という短期間で規格適合。今まで以上に実行度と効果の高い業務プロセスを確立
一般的に規格適合にむけたプロセス改善は1年以上の期間を要することが多いが、今回は活動開始から9ヶ月という短期間で規格適合に至りました。その後の機種でもプロセスの実践による規格適合の目処が立っています。また、プロセス定義の活動において品質保証部の視点から製品設計プロセスをレビューでき、今まで以上に品質面を意識した業務プロセスを確立することができたことも収穫となりました。
単なる規格対応ととらえず、製品設計プロセスを見直す良い機会ととらえてほしい
教科書にあるように上流からきれいに開発できている組織はこの規格対応を恐れることはないが、すり合わせながら変更を加え開発することが多い組織では手戻りや管理作業が多いだけでなく、この規格対応でも苦労することになります。単にエビデンスを揃える規格対応ととらえず、プロセスを見直す良い機会ととらえてほしいです。
-
※記載情報は取材時(2010年3月)におけるものであり、閲覧される時点で変更されている可能性があります。予めご了承ください。
-
※2024年1月1日に電通国際情報サービス(ISID)、アイティアイディ、ISIDビジネスコンサルティングは、電通総研へ商号変更しました。
社名、サービス名、その他の情報は発表当時のものです。あらかじめご了承ください。
